การแตกตัวของกรดอ่อน monoprotic
กรดอ่อนหรือเบสอ่อนเมื่อละลายน้ำจะแตกตัวได้เพียงบางส่วน ในสารละลายจึงมีไอออนและโมเลกุลที่ไม่แตกตัว ดังนั้นจึงเกิดการเปลี่ยนแปลงผันกลับได้เกิดภาวะสมดุลสารละลายกรดอ่อน-เบสอ่อน จัดว่าเป็นสารละลายอิเล็กโทรไลต์อ่อน
ตัวอย่างกรดอ่อน monoprotic
|
HCOOH |
formic acid |
|
HNO2 |
nitrous acid |
|
CH3COOH |
acetic acid |
|
HF |
hydrofluoric acid |
|
HCN |
hydrocyanic acid |
|
HClO2 |
chlorous acid |
เมื่อกรดอ่อน HA แตกตัวจะให้ไอออนลบและ H3O+ ดังสมการ
HA + H2O → H3O+ + A–
ตัวอย่าง HCOOH + H2O → H3O+ + HCOO–
HClO4 + H2O → H3O+ + ClO4–
HCN + H2O → H3O+ + CN–
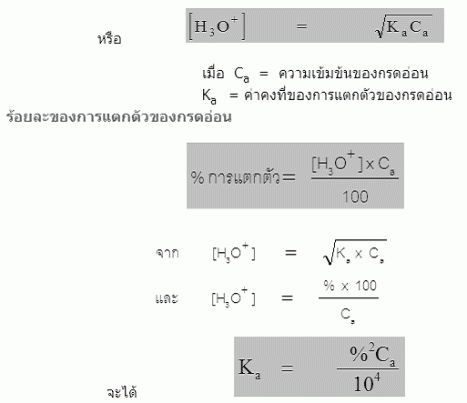
ความสัมพันธ์ระหว่างกรดอ่อนและไอออน ณ ภาวะสมดุล
พิจารณาการแตกตัวของกรด HA
| HA + H2O → H3O+ + A–
ความเข้มข้นเริ่มต้น Ca – 0 0 เปลี่ยนไป -x – +x +x ความเข้มข้นที่สมดุล Ca-x – x x |
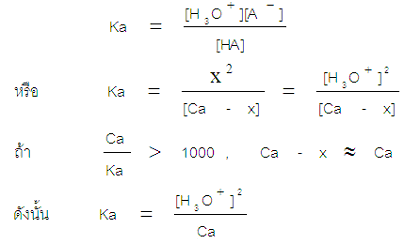
ค่าคงที่การแตกตัวของกรดอ่อนบางชนิดในน้ำที่ 25 oC
|
กรด |
สูตร |
ค่า Ka |
| ไฮโดรเจนซัลเฟตไอออน |
HSO4– |
1.2×10-2 |
| ไฮโดรฟลูออริก |
HF |
6.8×10-4 |
| ไนตรัส |
HNO2 |
4.5×10-4 |
| ไซยานิก |
HCN |
3.5×10-4 |
| ฟอร์มิก |
HCOOH |
1.7×10-4 |
| เบนโซอิก |
C6H5COOH |
6.6×10-5 |
| แอซิติก |
CH3COOH |
1.8×10-5 |
| ไฮโปคลอรัส |
HClO |
3.5×10-5 |
| แอมโมเนียมไอออน |
NH4+ |
6.0×10-10 |
| ไฮโดรไซยานิก |
HCN |
4.9×10-10 |
ค่าคงที่ของการแตกตัวของกรดอ่อน จะบอกให้ทราบถึงความสามารถในการแตกตัวเป็นไอออนในสารละลายได้ ถ้ากรดอ่อนมีความเข้มข้นเท่ากัน กรดอ่อนที่มีค่า ka มากที่สุดจะทำให้เกิด H3O+ มากที่สุด และจะเป็นกรดอ่อนที่มีความเป็นกรดสูงที่สุด
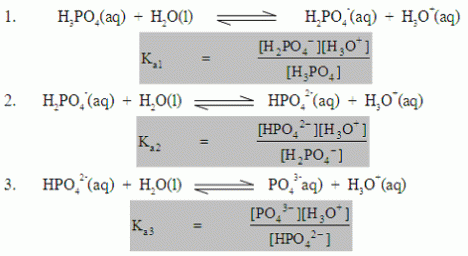
การแตกตัวของกรดอ่อน polyprotic
กรดอ่อนที่มี H มากกว่า 1 อะตอมจะแตกตัวให้ H3O+ มากกว่า 1 ไอออนเรียกกรดประเภทนี้ว่ากรดพอลิโปรติก
ตัวอย่างกรดอ่อน polyprotic
| H3PO4 | phosphoric acid |
| H3PO3 | phosphorous acid |
| H3BO3 | boric acid |
| H2CO3 | carbonic acid |
| H2SO3 | sulfurous acid |
การแตกตัวของกรดประเภทนี้มีได้หลายขั้น แต่ละขั้นจะมีปริมาณการแตกตัวแตกต่าง
กันการแตกตัวของกรด H3PO4 เกิดได้ 3 ขั้นดังนี้
กรดพอลิโปรติก ถ้าแตกตัวให้ H3O+ 2 ไอออนเรียกว่ากรดไดโปรติก เช่น H2SO4ถ้าแตกตัวให้ H3O+ 3 ไอออนเรียกว่ากรดไตรโปรติก เช่น H3PO4 การแตกตัวของกรพอลิโปรติกจะมีมากกว่า 1 ขั้น และแต่ละขั้นจะมีค่า Ka เฉพาะตัว โดยทั่วไปค่า Ka1 มีค่ามากกว่าค่า Ka2 และค่า Ka2 มากกว่าค่า Ka3ในการเปรียบเทียบการแตกตัวของกรดจึงมีเปรียบเทียบจากค่า Ka1สำหรับกรด H3PO3 แม้จะมี H 3 อะตอมแต่สามารถเกิดการแตกตัวได้เพียง 2ขั้นเท่านั้น
ค่าคงที่การแตกตัวของเบสอ่อนบางชนิดในน้ำที่ 25 oC
|
กรด |
สูตร |
|
ค่า Kb |
|
ฟอสฟอรัส
|
H3PO3
|
H3PO3 + H2O → H3O+ + H2PO3– |
Ka1=1.6×10-2 |
| H2PO3– + H2O → H3O+ + HPO32- | Ka2=6.3×10-7 | ||
|
ออกซาลิก
|
H2C2O4
|
H2C2O4 + H2O→H3O+ + HC2O4– |
Ka1=5.6×10-2 |
| HC2O4– + H2O → H3O+ + C2O42- | Ka2=5.1×10-5 | ||
|
ซัลฟิวรัส
|
H2SO3
|
H2SO3 + H2O → H3O+ + HSO3– |
Ka1=1.3×10-2 |
| HSO3– + H2O → H3O+ + SO32- | Ka2=6.8×10-8 |
ค่าคงที่ของการแตกตัวของกรดอ่อนพอลิโปรติกจะบอกให้ทราบถึงความสามารถในการแตกตัวเป็นไอออนในสารละลายได้เช่นเดียวกับค่าคงที่การแตกตัวของกรดอ่อนมอนอโปรติก