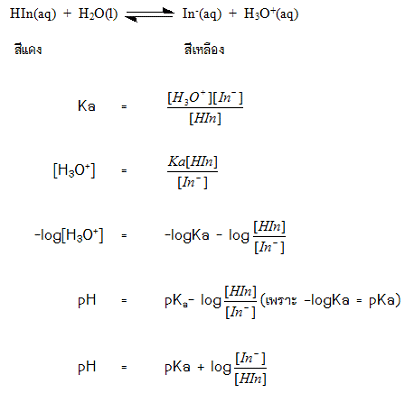อินดิเคเตอร์สำหรับกรด – เบส
อินดิเคเตอร์เป็นสารที่ใช้บอกความเป็นกรด – เบสของสารละลาย ส่วนใหญ่เป็นสารอินทรีย์ประเภทสีย้อมและมีสีต่างๆ กัน มีสูตรโครงสร้างที่ซับซ้อนและมีสมบัติเป็นกรดอ่อนเพื่อความสะดวกจึงสมมุติให้มีสูตรเป็น HIn อินดิเคเตอร์ชนิดหนึ่ง ๆ จะมีโครงสร้าง 2 แบบซึ่งมีสีแตกต่างกันเมื่ออินดิเคเตอร์ละลายน้ำหรืออยู่ในสารละลายจะมีการแตกตัวเป็นไอออนการที่มีสมบัติเป็นกรดอ่อนจึงทำให้มีภาวะสมดุลเกิดขึ้น เขียนแสดงได้ด้วยสมการดังนี้
ในปฏิกิริยาจะพบว่า HIn และ In- เป็นคู่กรด-เบส ซึ่งกันและกัน HIn มีโครงสร้างเป็นกรดจึงเรียกว่า รูปกรด ในขณะที่คู่เบส คือ In- เป็นโครงสร้างที่แสดงสมบัติเป็นเบสจึงเรียกว่า รูปเบส โครงสร้างของรูปกรดและรูปเบส สำหรับอินดิเคเตอร์ชนิดหนึ่งๆจะมีสีไม่เหมือนกันและมีปริมาณอยู่ในสารละลายต่างกันจึงทำให้สีของสารละลายเปลี่ยนแปลงไปได้ในสารละลาย ถ้ามีโครงสร้างของรูปใดมากกว่า สารละลายจะมีสีตามรูปนั้น การที่จะมีรูปกรดหรือรูปเบสมากกว่ากันจะขึ้นอยู่กับปริมาณของ H3O+ในสารละลายหรือขึ้นอยู่กับ pHของสารละลายนั่นเอง ดังนั้นอินดิเคเตอร์จึงมีสีเปลี่ยนแปลงไปตามค่า pH ของสารละลาย ทำให้สามารถบอกความเป็นกรด-เบส ของสารละลายจากการดูที่สีของอินดิเคเตอร์
(ที่มา : http://www.il.mahidol.ac.th/e-media/acid-base/C8.HTM)
ตัวอย่างการเปลี่ยนสีของเมทิลเรด ซึ่งเป็นอินดิเคเตอร์ที่มีสมบัติเป็นกรดอ่อนเมื่ออยู่ในรูปโมเลกุล (HIn) ซึ่งเป็นรูปกรด (acid form) จะมีสีแดง และเมื่ออยู่ในรูปไอออน (In–) ซึ่งอยู่ในรูปเบส (base form) หรือเป็นคู่เบสจะมีสีเหลือง เมื่ออยู่ในสารละลายที่มีน้ำเป็นตัวทำละลายจึงมีภาวะสมดุล ดังสมการ
เมทิลเรดจะปรากฎสีใดขึ้นอยู่กับปริมาณของ HIn และ In– ดังนี้
1. ในสารละลายที่มี H3O+ มาก เนื่องจากการเติมกรดลงในสารละลายตามหลักของเลอชาเตอลิเอร์สมดุลจะเลื่อนมาทางซ้าย ทำให้เกิด [HIn] มาก อินดิเคเตอร์จะปรากฎเป็นสีแดงมากกว่าสีเหลือง ดังสมการ
2. ในสารละลายที่มี OH– มาก เนื่องจากการเติมเบสลงในสารละลาย สมดุลจะเลื่อนไปทางขวามากขึ้น เพราะ OH– ไปทำปฏิกิริยากับ H3O+ ทำให้ [H3O+] ลดลง เกิดปฏิกิริยาไปข้างหน้ามากขึ้น [In–] จึงเพิ่มขึ้นอินดิเคเตอร์จะปรากฎสีเหลืองมากกว่าสีแดง
3. ในสารละลายที่มีค่าความเข้มข้นของ HIn และ In- ใกล้เคียงกัน สีของอินดิเคเตอร์จะเป็นสีผสมระหว่างสีของรูปกรดและรูปเบสผสมกัน ในกรณีของเมทิลเรดจะได้สีส้มซึ่งเป็นสีผสมระหว่างสีแดงกับสีเหลืองและเรียก pH ของสารละลายช่วงสีผสมนี้ว่า“ช่วง pH ของการเปลี่ยนสี
(pH range) ของอินดิเคเตอร์” ดังสมการต่อไปนี้
จากอัตราส่วนระหว่าง [HIn] ต่อ [In–] มีผลต่อสีของอินดิเคเตอร์ ดังนี้
ถ้าอัตราส่วนของ [HIn] ต่อ [In–] = 1 : 1 ได้สีส้ม
ถ้าอัตราส่วนของ [HIn] ต่อ [In–] = 10 : 1 ได้สีแดง
ถ้าอัตราส่วนของ [HIn] ต่อ [In–] = 1 : 10 ได้สีเหลือง
ดังนั้น ช่วงปรับเปลี่ยนสีของอินดิเคเตอร์ที่มีสมบัติเป็นกรดอ่อน คือ ช่วง pHที่ทำให้อัตราส่วนระหว่าง [HIn] ต่อ [In–] เปลี่ยนจาก 10 ไปเป็น 0.1 ถ้า [HIn] > [In–] ≥ 10 จะพบสีของสารละลายในรูปกรด
หรือเปลี่ยนสีที่
ถ้า
จะพบสีของสารละลายในรูปเบสหรือเปลี่ยนสีที่ช่วง pH = pKa + log10
= pKa + 1
แสดงว่าอินดิเคเตอร์ใดๆ จะเปลี่ยนสีที่ pH = pKa ± 1 ดังตัวอย่างต่อไปนี้
ตัวอย่าง อินดิเคเตอร์ชนิดหนึ่ง มีค่า Ka = 2×10-5 รูปกรดมีสีเหลือง รูปเบสมีสีน้ำเงิน
เติมลงในสารละลาย มีค่า pH = 3 จะได้สีอะไรและที่ pH 5.5 และ 9.2 สารละลายจะมีสีใด
แสดงว่า pH ต่ำกว่า 3.7 มีสีเหลือง สูงกว่า 5.7 มีสีน้ำเงิน และช่วง pH 3.7 ถึง 5.7
เมื่อเติมอินดิเคเตอร์ในสารละลาย pH = 3 จะมีสีเหลือง
pH = 5.5 จะมีสีเขียว
pH = 9.2 จะมีสีน้ำเงิน
ส่วนช่วง pH ที่ทำให้อินดิเคเตอร์ที่เป็นเบสอ่อนเปลี่ยนสี คือ ช่วงที่ pH = pKa ± 1
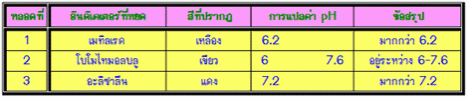
ตารางแสดงช่วง pH ที่เปลี่ยนสีของอินดิเคเตอร์บางชนิด
(ที่มา : http://www.lks.ac.th/student/kroo_su/chem22/indi.htm)
ผลการวิเคราะห์ข้อมูลจากตารางพบว่า อินดิเคเตอร์แต่ละชนิดเปลี่ยนสีที่ค่า pHต่างกัน มีช่วง pH ของการเปลี่ยนสีกว้างต่างกัน อินดิเคเตอร์ที่มีช่วง pH เปลี่ยนสีที่กว้างมากจะไม่สามารถบอกความเป็นกรด – เบส ได้ถูกต้อง ถ้าใช้อินดิเคเตอร์เพียงชนิดเดียวถ้าใช้อินดิเคเตอร์หลายชนิดทดสอบค่า pH ของสารละลาย จะสามารถประมาณค่า pHได้ใกล้เคียงที่สุด โดยการวิเคราะห์ค่าpH แล้วหาช่วงที่มีค่า pH ซ้ำกัน จะเป็นค่า pH ของสารละลาย ดังตัวอย่างตัวอย่างที่ 1 การทดลองหาค่า pH ของสารละลายชนิดหนึ่ง โดยใช้อินดิเคเตอร์ 5 ชนิดด้วยกัน ผลการทดลองเป็นดังนี้
|
ชนิดของอินดิเคเตอร์ |
ช่วง pH |
สีที่เปลี่ยน |
สีสารละลายที่ได้จากการทดลอง |
| 1. methyl yellow 2. Bromeresol green 3. Methyl red 4. Bromothymol blue 5. Phenophtalein |
2.9-4.0 |
สีแดง-เหลือง |
เหลือง |
ให้หาค่า pH ของสารละลายจากข้อมูลการทดลองข้างต้น
แนวคิด จากอินดิเคเตอร์ชนิดที่ 1 แสดงว่า pH ของสารละลาย > 4 จากอินดิเคเตอร์
ชนิดที่ 2แสดงว่า pH ของสารละลายอยู่ระหว่าง 4.4-6.2 จากอินดิเคเตอร์ชนิดที่ 3 แสดงว่า
pH ของสารละลาย > 5.4 จากอินดิเคเตอร์ชนิดที่ 4 แสดงว่า pH ของสารละลาย < 6
จากอินดิเคเตอร์ชนิดที่ 5 แสดงว่า pH ของสารละลาย < 8.0 สรุปได้ว่า สารละลายมีpH อยู่ระหว่าง 5.4 – 6
ตัวอย่างที่ 2 กำหนดชนิดของอินดิเคเตอร์ช่วง pH ที่เปลี่ยนสีและสีที่เปลี่ยนให้ ดังนี้
นำสารละลาย X ซึ่งใสไม่มีสีมา 3 หลอด หยดอินดิเคเตอร์ ได้ผลดังนี้
pH ของสารละลาย X เท่ากับ 7.2 – 7.6 เนื่องจากเป็นช่วง pH ที่ซ้ำกันของอินดิเคเตอร์
ทั้ง 3 ชนิดและสามารถสรุปได้ว่าสารละลายมีสมบัติเป็นเบสเนื่องจาก pH มากกว่า 7 ดังนั้น ถ้านำอินดิเคเตอร์หลายชนิด ซึ่งเปลี่ยนสีของสารละลายได้ในช่วงpH แตกต่างกันมากผสมกันในอัตราส่วนที่เหมาะสม จะได้อินดิเคเตอร์ที่ค่า pHของสารละลายได้ชัดเจนมากขึ้น เรียกว่า“ยูนิเวอร์ซัลอินดิเคตอร์(universal indicatior)”ทำให้สามารถระบุค่า pHของสารละลายตั้งแต่ pH1-14
(ที่มา : http://www.camlab.co.uk/item.asp?itemid=21331&categoryid=204&browsecategoryid=307)
(ที่มา : http://ujutchemical.exteen.com/20060911/entry-3)
ยูนิเวอร์ซัลอินดิเคเตอร์ที่ใช้โดยทั่วไป ได้จากการผสมอินดิเคเตอร์ 4 ชนิด คือ
เมทิลเรด เมทิลออเรนจ์ ฟีนอล์ฟทาลีน และโบรโมไทมอลบลู ในอัตราส่วนที่เหมาะสมทำให้เปลี่ยนสีได้เกือบทุกช่วงของ pH เช่นที่ pH=3
เมทิลออเรนจ์และเมทิลเรดจะมีสีแดง ฟีนอล์ฟทาลีนไม่มีสี โบรโมไทมอลบูลมีสีเหลืองเมื่อรวมกันยูนิเวอร์ซัลอินดิเคเตอร์จะให้สีที่ปรากฏเป็นสีแดงส้มที่ pH เท่ากับ 3กระดาษ pH เป็นกระดาษที่ชุบด้วยยูนิเวอร์ซัลอินดิเคเตอร์ใช้ทดสอบความเป็นกรด-เบสของสารละลายได้สะดวก โดยการตัดเป็นชิ้นเล็กๆและนำสารละลายมาแตะบนกระดาษ แล้วนำผลที่ได้ไปเทียบสีของค่า pH ที่แผ่นเทียบสีบนกล่องบรรจุกระดาษ pHทำให้สามารถระบุค่า pH ของสารละลายได้ สีที่สกัดได้จากส่วนต่างๆ ของพืชจะเปลี่ยนสีในช่วง pH ต่างๆ ได้ ดังนั้นจึงสามารถนำมาใช้เป็นอินดิเคเตอร์ ดังตัวอย่างต่อไปนี้
ตารางแสดงอินดิเคเตอร์จากพืชที่สกัดด้วยน้ำ
|
ชนิดของพืช |
ช่วง pH ที่เปลียนสี |
สีที่เปลี่ยน |
| ดอกอัญชัน |
1-3 |
แดง-ม่วง |
| ดอกกระเจี๊ยบ |
6-7 |
แดง-เขียว |
| ขมิ้นชัน |
6-7 |
เหลืองส้ม |
| ขมิ้นชัน | 11-12 | ส้ม-น้ำตาล |
| ชบาซ้อน | 7-8 | แดง-เขียว |
| ดาวเรืองเหลือง | 9-10 | ไม่มีสี-เขียว |
| กล้วยไม้ | 10-11 | ไม่มีสี-เหลือง |
| ทองกวาว | 11-12 | เหลืองเขียว-แดง |
จากตารางพบว่า สีจากพืชสามารถเปลี่ยนสีในช่วง pH ต่างๆ กัน ดังนั้น
อาจเตรียมอินดิเคเตอร์จากสารสกัดจากส่วนต่างๆ ที่มีสีของพืชได้ นอกจากนี้การวัดค่า pH ของสารละลายอาจใช้เครื่องมือที่เรียกว่า “พีเอชมิเตอร์
(pH meter)” เป็นเครื่องมือที่ใช้วัดค่า pH ของสารละลายที่ปรากฎเป็นตัวเลขที่มีค่าถูกต้องและละเอียดยิ่งขึ้น